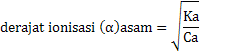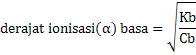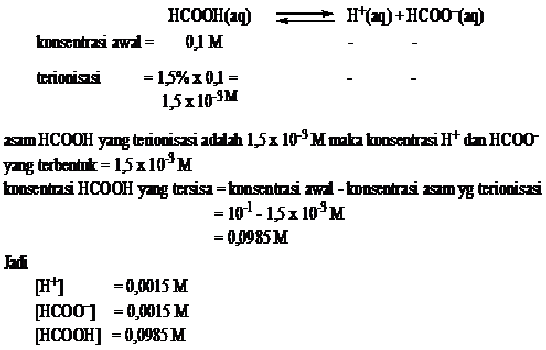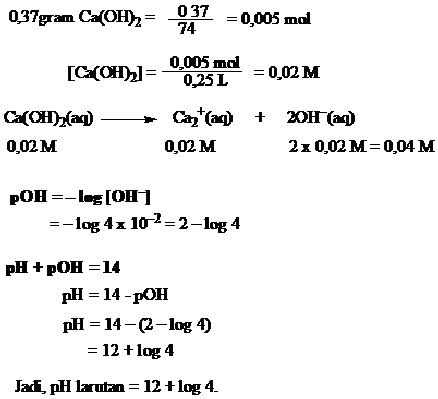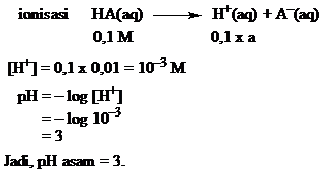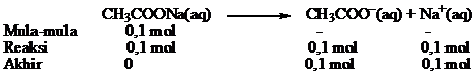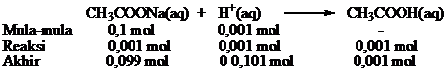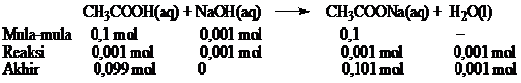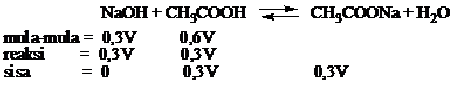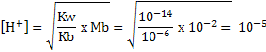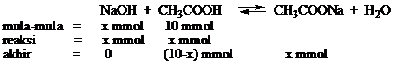Persamaan ionisasi air
H2O <=> H+ + OH‾
Dari reaksi di atas sesuai hukum kesetimbangan, tetapan kesetimbangan (K) ditulis sebagai berikut.
K [H2O] = [H+] [OH‾]
Kw = [H+] [OH‾]
pada temperatur 25 °C diperoleh harga Kw = 1,0 x 10-14
Artinya pada temperatur 25 °C dalam satu liter air murni terdapat 10-7 ion H+ dan 10-7 ion OH‾.
Contoh Soal 1
Berapa konsentrasi H+ dan OH– dalam 500 mL larutan HCl 0,1 M?
Jawab
HCl(aq) → H+(aq) + Cl–(aq)
Perbandingan koefisien = 1 : 1 : 1
Konsentrasi OH– dalam HCl 0,1 M adalah
[H+] [OH–] = 10–14 M
0,1 M [OH–] = 10–14 M
Contoh soal 2
Berapa konsentrasi ion H+ dan ion SO42– dalam 500 mL larutan H2SO4 0,2 M?
Jawab
H2SO4(aq) → 2H+(aq) + SO42–(aq)
Perbandingan koefisien = 1 : 2 : 1
Contoh soal 3
Berapa konsentrasi OH– dan H+ dalam larutan NaOH 0,2 M?
Jawab
NaOH(aq) → Na+(aq) + OH–(aq)
Perbandingan koefisien = 1 : 1 : 1
[H+] [OH–] = 10–14 M
[H+] x 0,2 = 10–14 M
Tetapan Ionisasi Asam Basa
Asam dan basa kuat terionisasi seluruhnya sehingga tidak memiliki tetapan kesetimbangan. Namun asam dan basa lemah memiliki tetapan kesetimbangan karena dalam air hanya terurai atau hanya terionisasi sebagian. Misalnya suatu asam lemah (HA) dilarutkan dalam air akan terurai sesuai persamaan berikut.
HA(aq) <==> H+(aq) + A–(aq)
[H+] = [A–] maka
[H+]2 = Ka.[HA]
Dengan cara yang sama
dengan Ka = tetapan ionisasi asam
Ca = konsentrasi asam awal
Kb = tetapan ionisasi basa
Cb = kosentrasi basa.
Dari rumus di atas, konsentrasi H+ dan OH- dari asam lemah dan basa lemah dapat ditentukan asal harga Ka dan Kb diketahui.
Hubungan Ka, Kb dengan derajat ionisasi asam dan basa
Ka = Ca x α2
Kb = Cb x α2
Jika Ka dan Kb disubstitusikan ke rumus
Akan diperoleh persamaan sebagai berikut
Contoh soal cara menghitung konsentrasi H+
Tentukan [H+] yang terdapat dalam asam formiat 0,01 M. Jika diketahui Ka. HCOOH = 1,7 x 10–4.
Jawab
Reaksi ionisasi HCOOH
HCOOH(aq) <==> H+(aq) + HCOO–(aq)
Contoh soal menghitung konsentrasi OH-
Tentukan [OH–] yang terdapat dalam larutan amonia 0,5 M jika diketahui Kb.NH3 = 1,8 x 10–5.
Jawab
Dalam air NH3 terionisasi sebagai berikut = NH4OH(aq) <==> NH4+(aq) + OH–(aq)
Contoh 1
Berapa konsentrasi H+, HCOO–, dan HCOOH dalam larutan asam formiat 0,1 M,
jika derajat ionisasinya 1,5%.
Jawab
Contoh 2
Derajat ionisasi asam cuka 0,1 M adalah 1%. Berapa [H+] dan Ka asam cuka tersebut?
Jawab
[H+] = Ca x α
= 0,1 x 0,01 = 10-3 M
Ka = Ca x α2
= 0,1 x (0,01)2 = 10–5 M
Contoh 3
Suatu larutan basa lemah NH4OH 0,1M dalam air terionisasi 1%. Tentukan:
a. Kosentrasi OH– yang terbentuk,
b. Harga Kb
Jawab
[OH–] = Cb x α
= 0,1 x 0,01
= 0,001 M
= 1 x 10-5
Derajat Keasaman dan kebasaan (pH dan pOH)
Kw = [H+] [OH–]
pKw = pH + pOH
Kw = 1,0 x 10-14
pKw = 14
14 = pH + pH atau pH = 14 – pOH atau pOH = 14 – pH
pH dan pOH untuk larutan asam, basa dan netral dapat diringkas seperti yang tertera pada Tabel.
| Larutan | [H+] | [OH–] | pH | pOH |
| Asam Netral Basa | > 10-7 = 10–7 < 10–7 | < 10-7 = 10–7 > 10–7 | < 7 = 7 > 7 | > 7 = 7 < 7 |
Sebelum masuk pada contoh soal perhatikan bebera cara atau langkah penyelesaian soal terkait asam basa:
Jika [H+] = 1 x 10-n, maka pH = n
Jika [H+] = x x 10-n, maka pH = n – log x
Jika pH = n, maka [H+] = 10-n
Jika [OH-] = 0,01 M, maka pOH = -log 0,01 = 2
Jika pOH = 3, maka [OH-] = 10-3 M
Jika pH larutan yang dicari adalah pH larutan asam dan basa lemah maka konsentrasi H+ dan OH- dapat dicari menggunakan persamaan
Contoh 1
Suatu larutan asam mempunyai konsentrasi H+ = 10–2 M, tentukan harga pH larutan tersebut.
Jawab
[H+] = 10–2 M
pH = – log [H+] = – log 10–2 = 2
Contoh 2
Suatu larutan basa mempunyai konsentrasi OH– = 5 x 10–3 M, tentukan harga pOH dan pH dari larutan tersebut.
Jawab
[OH–] = 5 x 10–3 M
pOH = – log [OH–]
= – log [5 x 10–3]
= – [log 5 + log 10–3]
= 3 – log 5
pH + pOH = 14
pH = 14 – pOH
= 14 – (3 – log 5)
= 11 + log 5
Contoh 3
Tentukan pH dari 500 mL larutan HCl 0,2 M.
Jawab
HCl merupakan asam kuat maka konsentrasi H+ yang dihasilkan sama dengan konsentrasi awal asam.
HCl(aq) → H+(aq) + Cl–(aq)
Konsentrasi HCl = 0,2 maka konsentrasi H+ = 0,2 M
pH = – log [H+]
= – log 2.10–1 = 1 – log 2
Contoh 4
100 mL larutan HBr 0,1 M diencerkan dengan aquades 100 mL. Tentukan:
a. pH mula-mula
b. pH setelah diencerkan.
Jawab
pH mula-mula
HBr adalah basa kuat maka konsentrasi H+ sama dengan konsentrasi HBr awal.
[H+] = [HBr] = 0,1 M = 10–1
pH = – log [H+] = – log 10–1 = 1
pH setelah diencerkan
Catatan: M (molar) = mol atau mmol zat dalam liter atau mL pelarut. Contoh larutan 1 M artinya 1 mol zat dalam 1 L larutan atau 1 mmol zat dalam 1 mL pelarut.
Mol HBr mula-mula = 100 mL x 0,1 mmol/mL = 10 mmol = 0,010 mol
Volum larutan = 100 mL HBr + 100 mL aquades = 200 mL = 0,2 L
Kosentrasi HBr setelah diencerkan:
[H+] = [HBr] = 0,05 = 5 x 10–2
pH = –log [H+] = –log 5 x 10–2 = 2 – log 5
Contoh 5
Tentukan pH larutan jika 0,37 gram kalsium hidroksida dilarutkan dalam 250 mL air?
Jawab
Contoh 6
Hitunglah pH larutan HCN 0,01 M (Ka HCN = 4,9 x 10–10)
Jawab
pH = – log [H+]
= – log 2,2 x10–6
= 6 – log 2,2 = 5,66
Contoh 7
Suatu asam lemah dengan harga α= 0,01 dan konsentrasi asam = 0,1 M. Hitunglah pH larutan asam tersebut.
Jawab
Contoh 8
Hitung pH larutan NH4OH 0,01 M (Kb NH4OH = 1,8 x 10–5)
Jawab
pOH = – log OH-
= -log 4,2 x 10–4
= 4 – log 4,2
pH = 14 – pOH
= 14 – (4 – log 4,2)
= 10 + log 4,2
= 10,6
Jadi, pH larutan = 10,6.
TITRASI ASAM BASA
Dasar titrasi asam basa yaitu reaksi asam basa.
Asam + basa <==> garam + air
Reaksi asam basa dalam bentuk larutan sebenarnya reaksi pembentukan air. Misalnya reaksi antara larutan NaOH dan HCl berlangsung sesuai persamaan berikut.
NaOH + HCl → NaCl + H2O
Jika reaksi di atas ditulis dalam bentuk ion maka ion Na+ dan ion Cl- pada reaktan dan produk ttetap ada.
Na+ + OH- + H+ + Cl- → Na+ + Cl- + H2O
Dalam tirtrasi asam basa, jika
· mol H+ = mol OH- maka campuran bersifat netral
· mol H+ > mol OH-, maka campuran bersifat asam dan konsentrasi ion H+ dalam campuran ditentukan oleh jumlah ion H+ yang tersisa.
· Mol H+ < mol OH- maka campuran bersifat basa dan konsentrasi ion OH- dalam campuran ditentukan oleh jumlah mol ion OH- yang tersisa.
Titrasi asam-basa menggunakan rumus konsentrasi dan volume asam maupun basa dihitung dengan persamaan berikut:
Vasam x Masam = Vbasa x Mbasa
dengan:
V = volum
Masam = molaritas H+
Mbasa = molaritas OH–
Titik ekivalen yaitu = pH pada saat asam dan basa tepat ekivalen
Titik akhir titrasi yaitu = pH pada saat indikator menunjukan perubahan warna
Jadi dalam titrasi asam basa, usahakan titik akhir titrasi dekat dengan titik ekivalen agar tidak terlalu banyak larutan asam atau basa yang berlebih. Hal ini dapat dilakukan dengan memilih indikator yang cocok atau indikator yang sesuai. Perlu ditekankan bahwa, dalam titrasi asam basa tidak semua indikator dapat digunakan.
Contoh 1
10 mL HCl yang tidak diketahui konsentrasinya dititrasi oleh larutan NaOH 0,1 M. Pada titik akhir titrasi ternyata rata-rata volum NaOH 0,1 M yang digunakan adalah 12,52 mL. Hitunglah konsentrasi HCl yang dititrasi.
Jawab
Vasam x Masam = Vbasa x Mbasa
10 mL x Masam = 12,52 mL x 0,1 M
Jadi konsentrasi HCl adalah 0,125 M.
Contoh 2
10 mL HCl X M dititrasi oleh larutan Ba(OH)2 0,1 M diperlukan 15 mL. Hitunglah konsentrasi HCl yang dititrasi.
Jawab
Vasam x Masam = Vbasa x Mbasa
10 mL x Masam = 15 mL x 0,2 M
Contoh 3
50 mL larutan NaOH dinetralkan melalui titrasi oleh 25 mL larutan HCl 0,2 M. Berapa massa NaOH yang terdapat pada larutan tersebut?
Jawab
Vasam x Masam = Vbasa x Mbasa
25 mL.0,2 M = 50 mL .MNaOH
0,1 M artinya terdapat 0,1 mol NaOH dalam setiap liter larutan atau 0,1 mmol NaOH dalam setiap liter larutan. Maka jumlah mol NaOH yang terdapat dalam 50 mL larutan NaOH
= 50 mL x 0,1 M = 5 mmol = 5.10–3 mol.
Yang ditanyakan adalah massa NaOH dalam larutan, maka mol NaOH x Mr NaOH (massa molar = massa molekul relatif NaOH)
= 5.10–3 mol x 40 g/mol = 0,2 g.
Contoh 4
Sebanyak 250 mL H2SO4 0,1 M dapat dinetralkan melalui titrasi oleh larutan KOH 0,3 M. Hitunglah volum KOH yang diperlukan (dalam mL)?
Jawab
H2SO4 → 2H+ + SO42–
Asam sulfat termasuk asam berbasa dua atau asam yang dapat melepaskan dua H+ dalam air, sehingga
[H+] = 2 x konsentrasi H2SO4 awal atau koefisien H+ x konsentrasi awal H2SO4
Vasam x Masam = Vbasa x Mbasa
250 mL x 0,2 M = Vbasa x 0,3 M
Jadi volume KOH yang diperlukan sebanyak 166,7 mL
Contoh 5
40 mL larutan NH4OH 0,2 M dicampurkan dengan 100 mL larutan HCl 0,02 M. Hitung massa (mg) garam yang terbentuk, jika diketahui Ar N = 14, H = 1, Cl = 35,5.
Jawab
Persamaan reaksi:
NH4OH(aq) + HCl(aq) <==> NH4Cl(aq) + H2O(l)
NH4OH yang ada = 40 mL x 0,2 mmol mL–1 = 8 mmol
HCl yang ada = 100 mL x 0,02 mmol mL–1 = 2 mmol
Pada persamaan reaksi di atas dapat diketahui bahwa perbandingan mol atau perbandingan koefisien NH4OH dan HCl = 1: 1. Oleh sebab itu, HCl sebagai pereaksi pembatas, artinya HCl akan habis terlebih dahulu karena lebih sedikit dibanding NH4OH.
Jadi produk yang terbentuk hanya tergantung pada mol atau mmol pereaksi pembatas, pada reaksi di atas garam (NH4Cl) yang terbentuk hanya tergantung pada mol atau mmol HCl.
NH4Cl yang terbentuk
Karena yang ditanyakan adalah massa garam yang terbentuk maka diperlukan Mr.garam
Mr.NH4OH = 53,5
Jadi massa molar NH4OH = 53,5 mg/mmol
Maka massa NH4OH = 2 mmol x 53,5 mg/mmol = 107 mg
LARUTAN BUFER ATAU LARUTAN PENYANGGA
Semua larutan yang dapat mempertahankan pH disebut larutan buffer atau larutan penyangga. Sifat larutan buffer antara lain: tidak berubah pH-nya meski diencerkan dan tidak berubah pH-nya meski ditambah sedikit asam atau basa atau karena pengenceran.
Larutan buffer di bagi menjadi larutan penyengga asam dan larutan buffer basa. buffer asam selalu mempunyai pH < 7, sedangkan buffer asam mempunyai pH >7.
Cara pembuatan buffer asam
1. Mencampur asam lemah dengan garam yang mengandung basa konjugasinya.
2. mencampurkan asam lemah dan basa kuat dengan jumlah asam lemah dibuat berlebih
Contoh
1. H2CO3 dicampur dengan NaHCO3, NaHCO3 membentuk ion HCO3– sehingga terbentuk larutan penyangga H2CO3/HCO3–.
2. Campuran larutan CH3COOH dengan larutan NaOH akan bereaksi dengan persamaan reaksi:
CH3COOH(aq) + NaOH(aq) → CH3COONa(aq) + H2O(l)
Jika jumlah CH3COOH yang direaksikan lebih banyak daripada NaOH, maka akan terbentuk CH3COONa dan ada sisa CH3COOH sehingga terjadi larutan penyangga CH3COOH/CH3COO–.
Cara pembuatan buffer basa
1. Mencampur basa lemah dengan garam yang mengandung asam konjugasinya.
2. mencampurkan basa lemah dan asam kuat dengan jumlah asam lemah dibuat berlebih
contoh
1. NH3(aq) dicampur dengan NH4Cl. NH4Cl membentuk ion NH4+, sehingga terbentuk larutan penyangga NH3/NH4+
2. Campuran NH3(aq) dengan HCl akan bereaksi dengan persamaan reaksi
NH3(aq) + HCl(aq) → NH4Cl(aq)
Jika jumlah NH3(aq) berlebih setelah bereaksi akan terbentuk NH4Cl dan ada sisa NH3(aq) sehingga terjadi larutan penyangga NH3(aq)/NH4+.
Contoh soal
Apakah terjadi larutan buffer jika 100 mL CH3COOH 0,5 M direaksikan dengan 200 mL NaOH 0,2 M?
Jawab
pH Larutan Buffer
pH buffer asam
Jika konsentrasi dinyatakan dengan molar (mol per liter), maka persamaan dapat ditulis sebagai
pH buffer basa
Jika konsentrasi dinyatakan dengan molar (mol per liter), maka persamaan dapat ditulis sebagai
Contoh 1
Sebanyak 1 L larutan penyangga mengandung CH3COOH 0,1 M dan CH3COONa 0,1 M. Jika Ka CH3COOH = 1,8 × 10–5, maka tentukan
a. pH larutan penyangga
b. pH larutan penyangga jika ditambah 10 mL HCl 0,1 M,
c. pH larutan penyangga jika ditambah 10 mL NaOH 0,1 M.
Jawab
a. Jumlah mol basa konjugasi (CH3COO–) diperoleh dari garam CH3COONa
Jumlah mol masing-masing zat dapat ditentukan dengan cara sebagai berikut.
Jumlah mol CH3COOH = 1 L × 0,1 mol.L-1 = 0,1 mol
Jumlah mol CH3COONa = 1 L × 0,1 mol.L-1 = 0,1 mol
pH larutan buffer dihitung dengan persamaan berikut
b. pH larutan penyangga jika ditambah 10 mL HCl 0,1 M
HCl merupakan suatu asam m,aka penambahannya sama dengan meningkatkan ion H+ dalam campuran. Jumlah mol HCl = 0,01 L × 0,1 mol.L-1 = 0,001 mol
H+ yang ditambahkan sama dengan konsentrasi mula-mula asam karena merupakan asam kuat dan akan bereaksi dengan akan bereaksi dengan CH3COO- membentuk CH3COOH yang tidak terionisasi.
Dari reaksi diperoleh
Mol CH3COO– = mol CH3COONa = 0,099
mol CH3COOH = 0,101
pH larutan penyangga setelah ditambah asam kuat HCl dapat dihitung sebagai berikut.
c. Pada larutan penyangga, CH3COOH akan menetralisir basa kuat NaOH yang ditambahkan. Jumlah mol NaOH yang ditambahkan. Dapat dihitung dengan cara sebagai berikut.
Jumlah mol NaOH = 0,01 L × 0,1 mol L–1 = 0,001 mol
NaOH merupakan basa kuat maka jumlah ion OH- yang ditembahkan sama dengan konsentrasi awal NaOH dan akan bereaksi H+ dalam larutan membentuk H2O. Agar tetap seimbang maka CH3COOH terurai menjadi CH3COO- dan H+. H+ yang terbentuk sebanyak yang bereaksi dengan OH-.
Persamaan reaksi dan jumlah mol masing-masing spesi.
Dari reaksi diperoleh
mol CH3COO– = 0,101
mol CH3COOH = 0,099
pH larutan penyangga setelah penambahan basa kuat dapat dihitung sebagai berikut.
Jadi, pH larutan penyangga jika ditambah 10 mL NaOH 0,1 M adalah 4,75.
Contoh soal 2
Ke dalam larutan penyangga yang terdiri dari 200 mL NH3 0,6 M dengan 300 mL NH4Cl 0,3 M (Kb NH3 = 1,8.10–5) ditambahkan air sebanyak 500 mL. Tentukan
a. pH larutan mula-mula
b. pH setelah di tambah 500 mL aquades.
Jawab
pH mula-mula
Jumlah mol NH3 = 0,6 M x 200 mL = 120 mmol = 0,12 mol
Jumlah mol NH4+ = 0,3 M x 300 mL = 90 mmol = 0,09 mol
Volum campuran = 200 mL + 300 mL = 500 mL = 0,5 L
pOH = –log 2,4.10–5
= 5 – log 2,4
= 4,62
pH = 14 – 4,62 = 9,38
Jadi, pH mula-mula adalah 9,38.
pH setelah di tambah 500 mL aquades
Penambahan aquades sama dengan pengenceran. Dalam pengenceran volume larutan bertambah besar, sehingga konsentrasi larutan menjadi kecil namun jumlah mol zat terlarut tidak berubah.
Dalam pengenceran berlaku rumus
| V1 x M1 = V2 x M2 |
Volum campuran (V2) = 200 mL NH3 + 300 mL NH4Cl + 500 mL aquades = 1000 mL = 1 L
M . NH3 = 0,6 M
M . NH4Cl = 0,3 M
Yang dicari V2 dari NH3 dan NH4+
pOH = –log 2,4.10–5 = 4,62
pH = 14 – 4,62 = 9,38
Jadi, pH setelah ditambah 500 mL air adalah 9,38.
CONTOH SOAL LAINNYA
Contoh 1
V mL NaOH 0,3 M ditambah 2V mL CH3COOH 0,3M, jika diketahui pKa CH3COOH = 5, tentukan pH lartuan yang terbentuk?
Jawab
Campuran di atas merupakan larutan penyangga asam (asam lemah + basa konjugasi)
pH = -log H+
pH = 5
perhatikan langkah kerja berikut sedikit berbeda dengan langkah-langkah yang telah dikerjakan sebelumnya tetapi tetap memberi hasil yang sama. Pada contoh terdahulu rumus
Langsung dijadikan pH dengan cara dikalikan –log, sehingga diperoleh rumus berikut
Sedangkan pada contoh di atas di cari terlebih konsentrasi H+. Baru di masukan pada pH = log H+.
Contoh 2
Tentukan pH larutan 0,01 M garam yang diperoleh dari basa lemah dan asam kuat bila diketahui Kb basa = 10-6?
Jawab
Contoh 3
Untuk membuat larutan pH = 5, maka ke dalam 100 mL larutan 0,1 M asam asetat (Ka = 105) harus ditambah NaOH sebesar…..(penambahan volume akibat penambahan diabaikan dan Mr.NaOH = 40)
Jawab
Massa NaOH = 5 mmol x 40 mg/mmol = 200 mg
Contoh 4
Tentukan konstanta asam HZ bila asam lemah HZ 0,5 M mempunyai pH = 4-log 5.
Jawab
pH = 4-log 5
H+ = 5 x 10-4
25 x 10-8 = Ka x 0,5
Ka= 5 x 10-7
Contoh 5
Suatu larutan penyangga di buat dengan mencampur 60 mL larutan NH3 0,1 M dengan 40 mL larutan NH4Cl 0,1 M. Berapa pH larutan penyangga yang diperoleh jika diketahui Kb.NH3 = 1,8 x 10-5?.
Jawab
Mol NH3 = 0,1 mmol mL-1 x 60 mL = 6 mmol
Mol NH4Cl = NH4+ = 0,1 mmol.mL-1 x 40 mL = 4 mmol
pH = – log OH
= -log 2,7 x 10-5
= 4,57
Karena yang ditanyakan pH, maka berlaku rumus
pKw = pH + pOH
14 = 4,57 + pOH
pOH = 14 – 4,57 = 9,43
jadi pH larutan buffer yang diperoleh 9,43